
Inhoud
- routebeschrijving
- Aantal elektronen in de valentie laag
- Lewis-structuur
- Formele lading van elk atoom
- waarschuwing
- Wat je nodig hebt
Bij het bepalen van de formele lading van een molecuul zoals CoCl2 (fosgeengas), is het noodzakelijk om het aantal elektronen in de valentie-laag van elk atoom en de Lewis-structuur van het molecuul te kennen.
routebeschrijving

-
Zoek naar elk atoom in het periodiek systeem der elementen om het aantal elektronen in de valentie-laag te bepalen.
-
Herinner dat twee elektronen zich in het eerste subniveau s bevinden, twee in het tweede subniveau s, zes elektronen in het eerste subniveau p, enzovoort. Recall: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Raak de lading. Als het molecuul een ion is, tel dan een of meer elektronen van het totaal op of trek deze af om de laatste lading te bereiken.
-
Voor CoCl2 (fosgeengas): C = 4; O = 6; Cl = 7. Het molecuul is niet geïoniseerd en heeft een neutrale lading. Daarom is het totale aantal elektronen in de valentie laag 4 + 6 + (7x2) = 24.
Aantal elektronen in de valentie laag
-
Zie het Lewis-structuurdiagram van CoCl2 (fosgeengas). De Lewis-structuur vertegenwoordigt de meest stabiele en waarschijnlijke structuur voor het molecuul. Atomen worden getekend met gepaarde valentie-elektronen; bindingen worden gevormd tussen vrije elektronen om te voldoen aan de octetregel.
-
Teken elk atoom en zijn valentie-elektronen en vorm dan, indien nodig, verbindingen.
Elektronen getrokken op de Lewis-structuur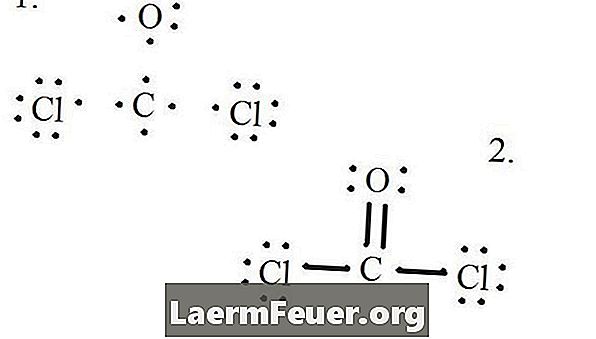
-
Chloride-atomen delen enkele bindingen met het koolstofmolecuul, terwijl het zuurstofatoom dubbele binding vormt met koolstof. Elk atoom in de uiteindelijke structuur voldoet aan de octetregel en heeft acht elektronen in de valentie laag, wat moleculaire stabiliteit mogelijk maakt.
Lewis-structuur
-
Tel de vrije elektronenparen van elk atoom in de Lewis-structuur. Elk atoom duidt een elektron aan van elke binding waaraan het deelneemt. Voeg deze nummers toe. In CoCl2: C = 0 vrije paren plus 4 bindingselektronen = 4 elektronen. O = 4 elektronen van vrije paren plus 2 elektronen van bindingen = 6 elektronen. Cl = 6 elektronen van vrije paren plus één elektron van één binding met C = 7 elektronen.
-
Trek de hoeveelheid van het aantal elektronen in de valentie laag op het ongebonden atoom af. Het resultaat is de formele lading voor elk atoom. In de CoCl2: C = 4 valentie-elektronen (ev) in het ongebonden atoom minus 4 elektronen aangeduid in de Lewis-structuur (LS) = 0 formele lading O = 6 ev - 6 LS = 0 formele lading Cl = 7 en - 7 LS = 0 formele aanklacht
Formele ladingen van atomen
-
Plaats deze ladingen bij het schrijven in de buurt van de atomen in de Lewis-structuur. Als het molecuul in totaal een lading heeft, plaatst u de Lewis-structuur tussen haakjes met de lading geschreven aan de buitenkant in de rechterbovenhoek.
Formele lading van elk atoom
waarschuwing
- De berekening van de formele lading voor moleculen die overgangsmetalen bevatten, kan verraderlijk zijn. Het aantal elektronen in de valentie laag voor overgangsmetalen zal dat zijn uit het edelgaspatroon.
Wat je nodig hebt
- Periodiek systeem der elementen